日期:2021年5月
Labcorp药物开发临床肿瘤提供了新的鼠标扩大C金博宝188网址ompMyeloid™面板,提供深immunophenotypic分析骨髓子集调节肿瘤免疫反应。
面板地址越来越需要了解免疫疗法调节pro-tumor粒细胞和抗肿瘤活性的肿瘤微环境。在这个科技的关注,我们证明这个18-color面板提供了一个深的力量深入骨髓immunophenotyping和功能性特征子集。
扩大CompMyeloid™面板构建在我们CompMyeloid™面板,它提供了一个通用的测量五个骨髓子集调节肿瘤免疫。改善面板添加DC1(1型)和DC2树突细胞描述(2型),加上六个额外的标记功能特征的肿瘤相关巨噬细胞(TAM) myeloid-derived抑制细胞(MDSC)和树突细胞的子集。表1描述了组件的扩展CompMyeloid™面板和图1说明了控制策略描述使用小鼠骨髓子集Hepa 1 - 6肝癌模型。
表1:扩大CompMyeloid™面板抗体和描述他们的效用
抗体/染料 |
描述 |
CD45 |
潘免疫细胞标记 |
CD11b |
Pan-myeloid谱系标记/标记DC2子集 |
CD103 |
DC1子集标记 |
Ly-6G |
Granulocytic-MDSC /中性粒细胞标记 |
Ly-6C |
Monocytic-MDSC /单核细胞标记 |
CD11c |
树突细胞标记 |
CD24 |
树突细胞的描述 |
F4/80 |
Pan-macrophage标记 |
MHC II级 |
M1巨噬细胞和树突细胞标记 |
CD206 |
M2巨噬细胞标记 |
XCR1 |
交叉呈现/迁徙树突细胞标记 |
CD80 |
成熟的标记 |
CD86 |
成熟的标记 |
__arg1 |
骨髓功能标志 |
伊诺 |
骨髓功能标志 |
PD-L1 |
T细胞抑制信号蛋白 |
CD19 |
B细胞标记 |
可行性染料 |
死细胞排斥 |
扩大CompMyeloid™面板提供immunophenotypic分析7不同骨髓子集包括G-MDSC /中性粒细胞,M-MDSC /单核子集,M1和M2巨噬细胞,DC1, DC2 XCR1 +树突状细胞(DC)的子集。5的分析骨髓功能标记树突细胞,巨噬细胞,MDSC表型。
|
|
扩大CompMyeloid™面板控制策略
符合所有Labcorp药物开发临床肿瘤学immunophenotyping面板、分析始于死细胞金博宝188网址排斥和后续CD45+免疫细胞的描述。对总CD11b封闭的+细胞,图1显示下游MDSC和TAM分析。图1 B演示了直流分析,细致的控制策略,首先不包括巨噬细胞、粒细胞、B细胞,最小化的风险无关紧要的直流测量受损是由于污染和潜在autofluorescent细胞。排除门口然后使CD24分析(图中未显示),帮助描绘传统DCs,由介质高表达水平一般分类CD11c和MHC II级。这些传统的DCs包括CD103+DC1和CD11b子集+DC2子集,这已经被证明是CD8开车+和CD4+T细胞抗肿瘤反应分别1。XCR1表达已经被多个组记录作为DCs cross-presenting活动的一个标志,一个DC-mediated激活CD8所需表型+T细胞2。

图。1。使用扩展分析肿瘤浸润骨髓子集CompMyeloid™面板。Hepa 1 - 6从C57BL / 6小鼠肿瘤收获。(一)从CD11b开始+测量细胞门,G-MDSC和M-MDSC子集,剩下的事件被划定为M1和M2 tam, (B)从巨噬细胞/ MDSC排斥大门,DC1和DC2子集,XCR1+直流测量分数。
所有动物的工作是网站机构动物保健和使用委员会批准,并按照执行指导实验室动物保健和使用的在一个AAALAC-accredited程序。在所有研究人道的安乐死标准预先确定的。
伊诺和精氨酸酶1分析MDSC和TAM子集
髓系肿瘤微环境中的子集传授活动,既有pro-tumor和抗肿瘤的作用。扩大CompMyeloid™面板提供了一个分析伊诺和精氨酸酶1 (__arg1);生物标记的骨髓功能的二元性的例子。伊诺和__arg1表达MDSC和TAM子集的肿瘤3。在MDSCs,伊诺和__arg1调解衬底的免疫抑制效应,竞争燃料T细胞增殖和抗肿瘤反应的精氨酸。肿瘤有很高的伊诺和__arg1表达会导致精氨酸剥夺环境导致可怜的T细胞活化。因此,疗法减少伊诺的表达和__arg1 MDSCs有可能促进T细胞激活和改善临床结果。值得注意的是,伊诺在T cell-independent表达式还可以抑制肿瘤的生长方式,作为一氧化氮基因产物可以对肿瘤细胞有直接细胞毒性效应抑制疾病进展。伊诺M1极化巨噬细胞可以诱导表达的增长逮捕以及诱导凋亡细胞死亡在不同的模型4、5。相反__arg1 M2极化巨噬细胞表达的肿瘤微环境抑制T细胞反应的方式的机械化MDSCs相似。
图2演示了如何扩大CompMyeloid™面板可以在骨髓检查进气阀打开,__arg1子集,使用皮下Hepa 1 - 6肝癌模型。我们使用这个模型因为检查点通过anti-PD-1治疗抑制肿瘤生长抑制(图中未显示),从而提供一个机会来检查骨髓间如何响应在检查站封锁。控制动物相比,anti-PD-1治疗增加伊诺和__arg1的表达在肿瘤浸润粒细胞(G)和单核细胞的(M) MDSC子集(图2)。相比之下,分析总tam证明增加伊诺表达式与一个小而显著减少__arg1表达式(图2 b)。值得注意的是,在伊诺积极tam,似乎细胞有bi-phasic伊诺表达谱。而且,MHC II级较高的表达在伊诺高细胞分数表明一个增强抗原表示和T细胞激活的能力。是伊诺和__arg1分别标记为M1和M2极化、数据显示,anti-PD-1 TAM平衡治疗转向M1极化和抗肿瘤表型。数据也提醒人们,肿瘤免疫反应是动态的,免疫疗法可以触发pro-tumor之间的多层次影响推和拉和抗肿瘤活性。
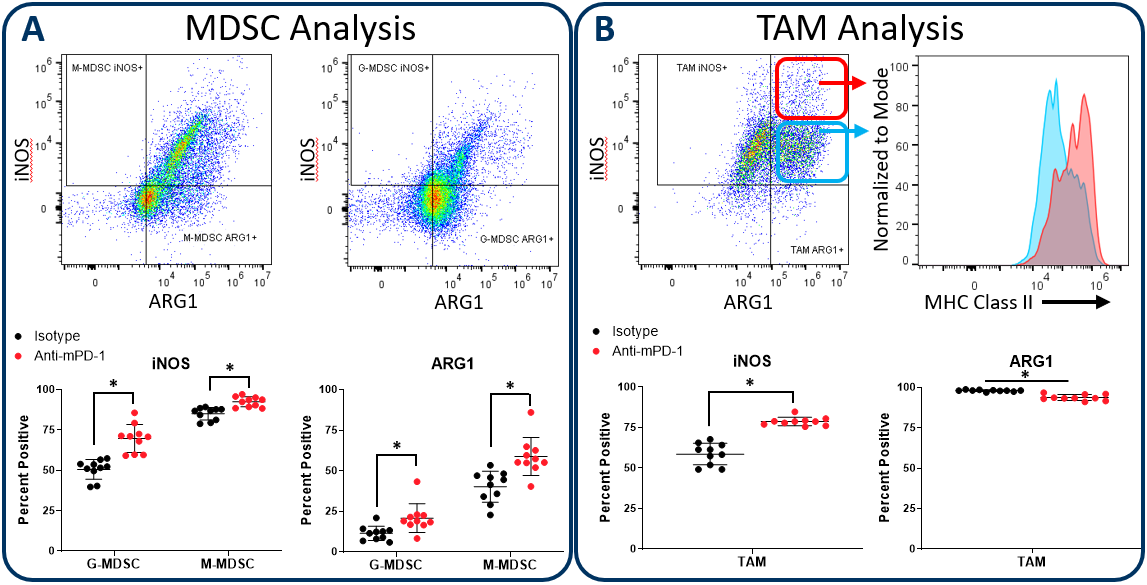
图2。伊诺和精氨酸酶1分析MDSC和TAM子集。扩大CompMyeloid™面板措施生物标记骨髓功能。在这个数据,Hepa 1 - 6肿瘤是从anti-PD-1收获和同形像控制抗体治疗的老鼠。MDSCs (A)和tam (B)被划定为伊诺和__arg1表达和分析。tam差异表达相对较高(红色圈封闭)和低(蓝色圆形封闭)水平的进气阀打开表达式,直接与MHC II级表现在这些细胞分数,这是符合M1极化(红色和绿色盖茨代表例子和没有在这种情况下用于生成MHC II级测量如图所示)。*学生T测试(p < 0.05)。
CD80和CD86成熟标志表达传统直流子集
传统树突状细胞在肿瘤微环境主要可以分为两个子集称为DC1和DC2,所确定的表达CD103 / XCR1和CD11b分别。两个子集可以激活T细胞。然而,DC1已被证明有利于CD8细胞+由于一个增强T细胞活化能力cross-presentation引流淋巴结的肿瘤相关抗原,这一过程是由XCR1表达式6。在上述Hepa 1 - 6研究,扩大CompMyeloid™面板是用来测量CD80和CD86 costimulatory分子表达的最大所需抗原呈递细胞和T细胞通过细胞激活contact-dependent机制7。图3说明了CD80和CD86在Hepa 1 - 6 tumor-derived树突细胞检测。此外,治疗anti-PD-1 DC1子集上增加CD86的表达水平比对照组同形像。数据表明,增强T细胞激活可能引发anti-PD-1抗体治疗,部分是由于增加CD86的表达DC1上细胞增强costimulatory活动在这个子集。
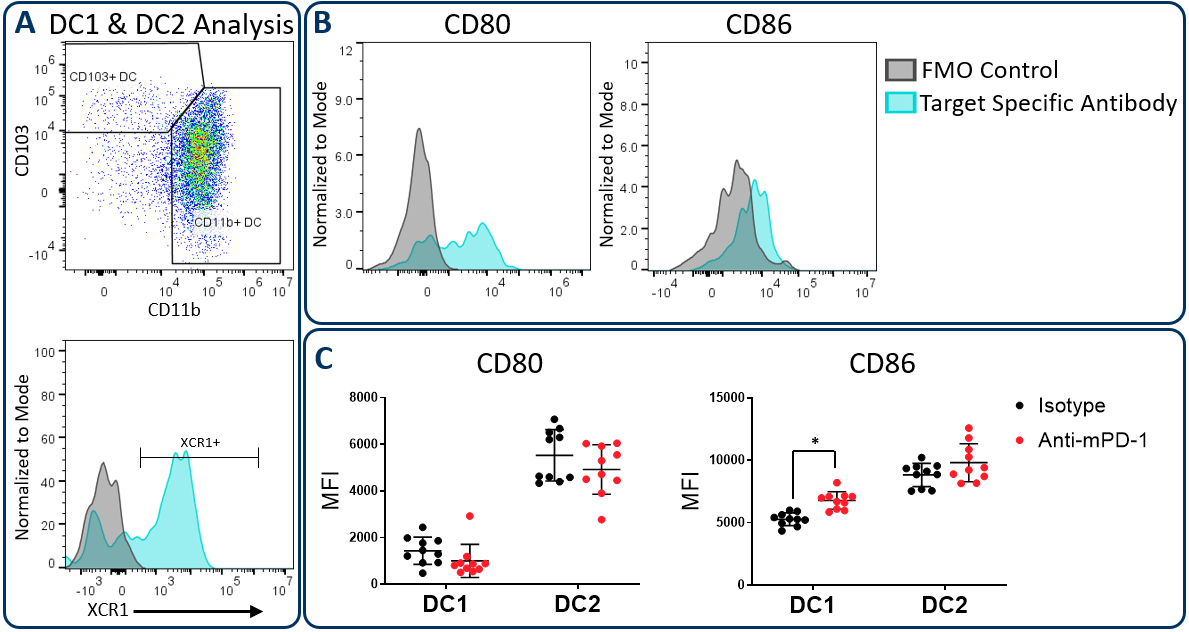
图3。CD80和CD86成熟标志表情直流子集。扩大CompMyeloid™面板是用来测量CD80和CD86 Hepa 1 - 6 tumor-derived细胞。(一)总DCs首先划定,然后表型DC1和DC2子集。XCR1测量的控制策略也显示。(B)直方图来演示代表CD80和CD86信号相比,荧光- 1 (FMO)负控制在DC1细胞。(C) CD80和CD86测量DC1和DC2子集Hepa 1 - 6 tumor-derived细胞。*学生T测试(p < 0.05)。
PD-L1分析骨髓子集和肿瘤细胞
PD-1 / PD-L1轴是一种最广泛的途径在癌症免疫治疗的目标。PD-L1可以调节肿瘤细胞逃避宿主保护性免疫的机制。此外,PD-L1表情一直在记录髓细胞包括巨噬细胞、树突细胞和MDSCs进一步抑制T细胞的活化作用8。在某些情况下,PD-L1表达在这些不同的细胞类型可以有冗余的角色9。在一起,这些观察强调的重要性了解PD-L1表达式的粒细胞可以调节肿瘤免疫治疗。图4展示的能力扩大CompMyeloid™面板来衡量PD-L1总TAM,特区G-MDSC / M-MDSC子集,以及CD45- - - - - -(无免疫力)细胞,包括肿瘤细胞和血管内皮细胞和其他细胞。如下所示,PD-L1检测在所有细胞类型检查Hepa 1 - 6 tumor-derived细胞。数据还显示,与对照组相比,anti-PD-1疗法对PD-L1表达水平没有影响这些细胞,表明PD-L1不是由检查点抑制调制在这个模型。
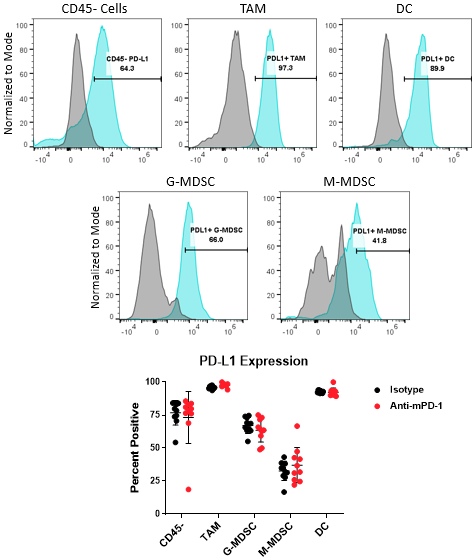
图4。PD-L1分析骨髓子集和肿瘤细胞。直方图显示代表PD-L1信号相比,荧光- 1 (FMO)负CD45的控制- - - - - -从Hepa 1 - 6 tumor-derived细胞细胞和骨髓的子集。所示的门被用来量化的百分比PD-L1阳性表达的细胞显示子集包含在同形像控制和anti-PD-1抗体治疗组。
使用扩展CompMyeloid™面板中,数据在这个科技焦点提出的证据表明,检查点抑制调节免疫活动在多个髓系肿瘤小鼠Hepa 1 - 6模型子集。此外,数据提供了额外的支持,anti-PD1治疗产生影响不局限于T细胞活动。
了解更多关于如何扩大CompMyeloid™面板可以纳入你的临床前研究,联系Labcorp药物开发的科学家。金博宝188网址
引用
1加德纳。,& Ruffell, B. (2016). Dendritic cells and cancer immunity. Trends in immunology, 37(12), 855-865.
2威利,B。,Seppanen, E., Xiao, K., Zemek, R., Zanker, D., Prato, S., ... & Waithman, J. (2015). Cross-presentation of cutaneous melanoma antigen by migratory XCR1+ CD103− and XCR1+ CD103+ dendritic cells. Oncoimmunology, 4(8), e1019198.
3Kumar V。,Patel, S., Tcyganov, E., & Gabrilovich, D. I. (2016). The nature of myeloid-derived suppressor cells in the tumor microenvironment. Trends in immunology, 37(3), 208-220.
4Rahat, m·A。,& Hemmerlein, B. (2013). Macrophage-tumor cell interactions regulate the function of nitric oxide. Frontiers in physiology, 4, 144.
5Vannini F。,Kashfi, K., & Nath, N. (2015). The dual role of iNOS in cancer. Redox biology, 6, 334-343.
6威利,B。,Seppanen, E., Xiao, K., Zemek, R., Zanker, D., Prato, S., ... & Waithman, J. (2015). Cross-presentation of cutaneous melanoma antigen by migratory XCR1+ CD103− and XCR1+ CD103+ dendritic cells. Oncoimmunology, 4(8), e1019198.
7Slavik, j . M。,Hutchcroft, J. E., & Bierer, B. E. (1999). CD28/CTLA-4 and CD80/CD86 families. Immunologic research, 19(1), 1-24.
8太阳,C。,Mezzadra, R., & Schumacher, T. N. (2018). Regulation and function of the PD-L1 checkpoint. Immunity, 48(3), 434-452.
9哦,美国。,Wu, D. C., Cheung, J., Navarro, A., Xiong, H., Cubas, R., ... & Mellman, I. (2020). PD-L1 expression by dendritic cells is a key regulator of T-cell immunity in cancer. Nature Cancer, 1(7), 681-691.
让我们开始对话
联系我们