作者:大卫•德雷伯博士、副主任、科学发展
日期:2022年2月
转录组分析可用于研究肿瘤微环境之间的交互(时差)和免疫系统,是一个强大的工具来调查的机械作用免疫疗法。在这个科技的关注,我们将演示如何使用nCounter基因表达以实体肿瘤®PanCancer IO 360™面板(NanoString技术)可以结合流式细胞术提供了一个综合评价的影响,免疫疗法的抗肿瘤免疫反应。
360™PanCancer IO面板770 -丛基因表达是一个面板,其中包括48个不同的基因签名检查癌症相关的免疫反应。分析IO 360™面板提供了一个客观的和整体的检查方法免疫细胞肿瘤浸润,肿瘤细胞,和相关的微环境。演示NanoString的效用分析时应用于临床前研究,anti-mPD-1(程序性细胞死亡1)治疗性抗体注射到老鼠轴承MB49肿瘤、金博宝188网址膀胱癌的小鼠模型。流式细胞术进行目标特定的生物标记物对各种职业和抗肿瘤的活动在不同的免疫子集。我们结合血细胞计数和IO 360™面板组件添加一个公正的结果分析,并提供一个全球immuno-oncology基因表达谱的时间处理与未经处理的动物。

图。1。肿瘤生长曲线anti-mPD-1和同形像控制治疗老鼠。MB49细胞植入皮下注射到腋窝区域。Anti-mPD-1抗体(克隆RMP1-14)管理IP每周两次总共4剂量。肿瘤恶化被卡尺测量监控。
流式细胞术分析MB49肿瘤浸润免疫子集
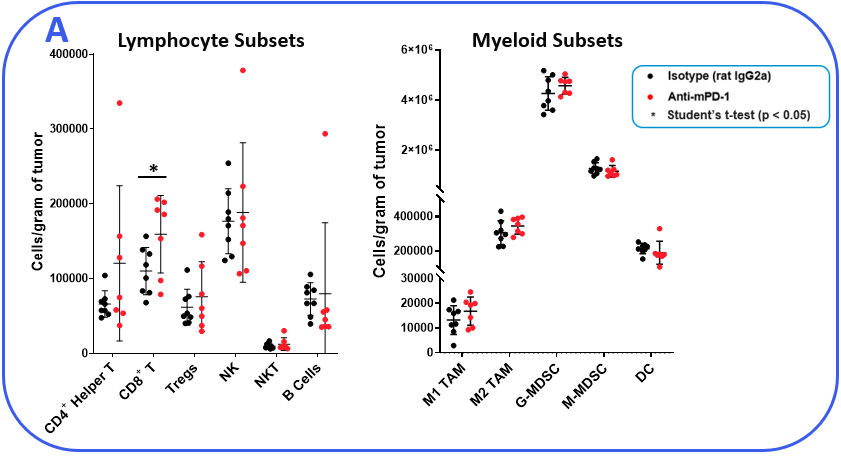
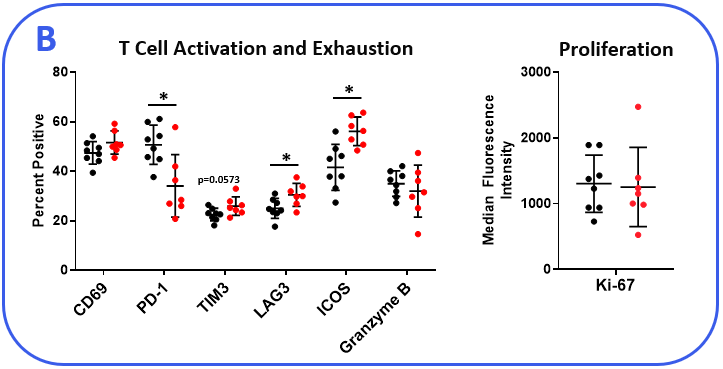
以确定MB49模型响应检查点抑制,肿瘤小鼠接受anti-mPD-1或同形像控制抗体。肿瘤生长曲线如图1所示展示MB49肿瘤适度回应anti-mPD-1治疗。Anti-mPD-1疗法控制肿瘤的生长通过定位PD-1 / PD-L1轴来提高T细胞抗肿瘤活性。分析anti-mPD-1 MB49模型中的影响,流式细胞仪进行检查绝对计数和肿瘤浸润T细胞的表型和其它子集。在测量子集,只有CD8+T细胞的动物相比,增加(图2)。来洞察CD8的活动+T细胞表面活化标记CD69的表达,诱导co-stimulator(这个理事会)和B granzyme测量。评估T细胞增殖,细胞内的表达ki - 67量化。最后,标记,与T细胞疲劳,包括PD-1、淋巴细胞激活基因3 (LAG-3)和T细胞免疫球蛋白和mucin-domain包含3 (TIM-3)测量(图2 b)。肿瘤浸润T细胞表达增强的国际安全和发展理事会anti-mPD-1对待动物控制相比,这是一个提供costimulatory信号的受体T细胞,促进他们的扩张和生存1。还值得注意的是,anti-mPD-1治疗调节T细胞疲惫标记,以观察PD-1表达减少,但增加LAG-3和TIM-3水平在对待动物。流式细胞术也被用来测量目标与骨髓细胞子集相关活动。伊诺和__arg1蛋白质调节免疫抑制活动myeloid-derived抑制细胞(MDSC)2。这两个蛋白的表达也与肿瘤相关巨噬细胞(TAM)极化,伊诺和__arg1分别被标记为M1和M2 TAM极化2。流分析证明进气阀打开,但不是__arg1表达式,较高的tam anti-mPD-1对待动物而控制。没有明显的表达水平的变化__arg1在tumor-derived tam,粒细胞(G)、单核细胞的(M) MDSC子集之间的组织。CD80和CD86 costimulatory分子抗原呈递细胞提供激活T细胞和信号通常是测量作为生物标志物在树突状细胞(DC)抗原表达能力。我们测量CD80和CD86 DC1和DC2细胞,这是主要的传统树突状细胞在肿瘤,发现子集anti-mPD-1没有提高这些costimulatory分子的表达。事实上,CD80表达减少DC2子集从对待动物(图2)。
空间
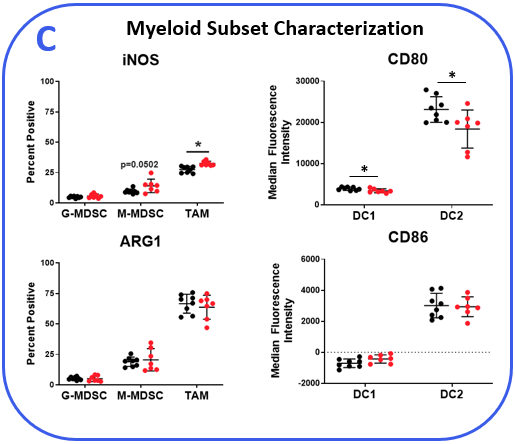
图2。MB49肿瘤是从anti-mPD-1收获和同形像控制抗体治疗的老鼠。(一)肿瘤浸润免疫子集描述使用流式细胞仪和标准控制策略(没有显示)。绝对计数测定使用CountBright™珠子(热费希尔科学)。(c)淋巴细胞和骨髓免疫的功能特征子集通过流式细胞术。DC1和DC2子集描述基于积极性CD103 CD11b标记分别在直流总分数。*学生T测试(p < 0.05)。
基因表达在MB49肿瘤使用nCounter®PanCancer IO 360™面板
获得转录组的洞察在MB49 anti-mPD-1治疗时间的影响,信使rna提取从肿瘤FFPE块准备收获后12天开始治疗。样品分析进行NanoString nCounter®平台用鼠标PanCancer IO 360™面板。分析由罗莎琳德™生物信息学确定62 770个基因的研究之间的差异表达anti-mPD-1和同形像控制抗体治疗组。此外,通路分析48基因签名检查360 IO™小组分配一个全球意义的分数来评估的总体水平微分表达式为每个基因集。集最广泛调制显示在表1中,其中包括干扰素信号,细胞毒性,细胞因子和趋化因子信号的签名。值得注意的是,所有的调制基因包含在这些集合在anti-mPD-1调节治疗组。图3描绘了这些基因的热图格式设置为帮助可视化anti-mPD-1治疗对基因表达的影响。9 61个基因构成的干扰素信号组治疗组之间的差异表达基因。值得注意的是,大多数基因被调制在此列表中介质刺通路的信号,包括Ifih1, Stat1, Ifit1, Ifit2 Ifit3, Irf73、4。10的50个基因构成的细胞毒性基因差异表达,还包括设置几个刺通路相关的基因。14 106个基因组成的细胞因子和趋化因子信号传导基因被anti-mPD-1治疗62个基因中调制。列表中包括基因,促进T细胞生存(Il2rb、Il21r Il7r, Il10ra),以及直流和T细胞招聘肿瘤(亚兰、Ccl5 Ccr5)5 - 8。数据的进一步分析表明,M1巨噬细胞配置文件增加(Stat1 Nos2 Tlr8, Tlr9识别)9。最后,为已知的临床免疫调节目标基因代码增加(Ido1、Tim3 Csf1r)指示的工作时间去抵消anti-mPD-1治疗的影响。
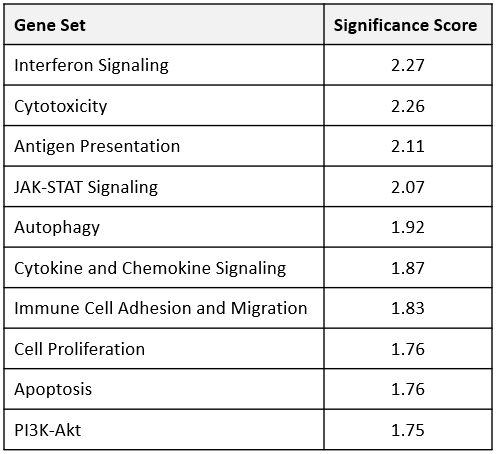
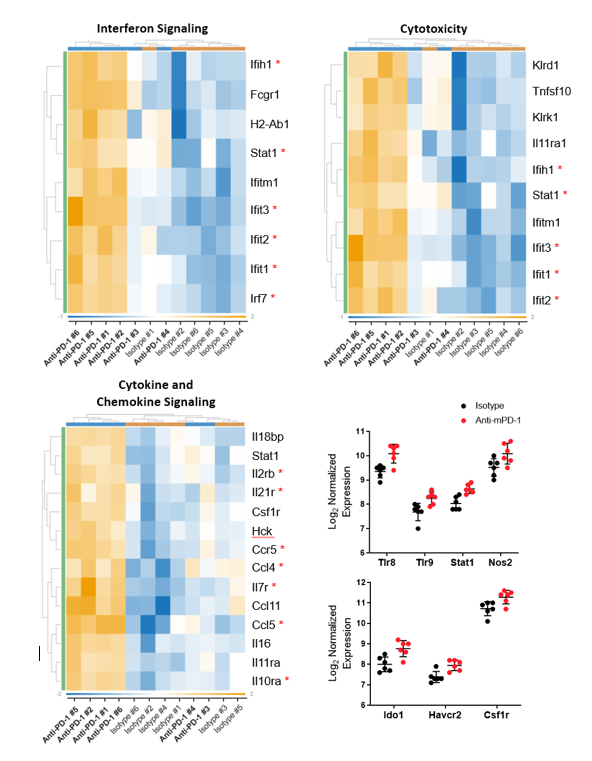
图3。差异表达基因的转录组分析从anti-mPD-1 MB49肿瘤治疗小鼠相比,控制动物。原始基因数量Log2 20看家基因转化和归一化。标准微分表达式与p < 0.05±1.5折变化。*表示基因在文本中讨论。
总结
综上所述,我们使用转录组分析评估anti-mPD-1治疗基因表达改变有关免疫反应之间的相互作用和时差MB49膀胱癌模型。结合流分析肿瘤浸润免疫细胞的转录组中提供深度和综合机械化的洞察anti-mPD-1 treatment-induced肿瘤生长抑制。
流分析证实CD8+anti-mPD1治疗小鼠T细胞浸润增加与对照组相比。然而,最小的影响被观察到在大多数其他生物标记物,也有针对性的分析。值得注意的是,360年IO™面板称赞流式细胞仪的数据通过提供冗余洞察一些抗肿瘤的治疗性接触的活动。因此,NanoString分析IO 360™面板可用于通过揭示机械的活动,有助于丰富的数据集通常会被人忽略使用其他有针对性的方法。
IO 360™面板分析显示anti-mPD-1治疗增加多个基因的表达与T细胞的生存。此外,在细胞表面活化标记测量,流式细胞仪分析显示anti-mPD-1 CD8调节这个理事会+受体T细胞,这是一个演示,促进T细胞的生存。ki - 67增殖标记没有被anti-mPD-1改变CD8水平+T细胞。因此,CD8 anti-mPD-1治疗的影响+T细胞浸润可能部分是由于ICOS-driven upregulation T细胞生存的基因。Anti-mPD-1也调节多个基因调节刺通路信号,细胞毒性的活动,和T细胞招聘。因此,提供额外的证据表明anti-mPD-1促进转录调节基因导致T细胞抗肿瘤反应。与驾驶相关的基因M1 TAM anti-mPD-1极化也调节。包含在这个列表是Nos2(间接宾语),这也证实了流式细胞术在tumor-derived巨噬细胞,表明治疗增强一些促炎信号髓室的时间去帮助对抗肿瘤的生长。
NanoString分析还表明,基因分析可以用来确定未来的研究实现联合治疗伙伴添加剂或协同的结果在活的有机体内。最引人注目的发现之一是基因治疗组编码的upregulation IDO1, TIM-3 CSF1R,提供信号,促进肿瘤的生长,也正在针对不同阶段的临床工作。这些基因的调节可能是另一种企图肿瘤逃避免疫系统由于PD-1 / PD-L1封锁。因此,综合治疗与anti-mPD-1 epacadostat, RMT3-23,或PLX5622抑制IDO1 TIM-3或CSF1R分别在MB49肿瘤模型有助于抵消pro-tumor anti-mPD-1治疗引发的反应,提高疗效。目前的设计研究,以测试这些假设。
关于我们NanoString功能的更多信息,请访问:https://drugdevelopment.labcorp.com/industry-solutions/oncology/金博宝188网址preclinical/in-vitro/dna-rna-expression-analysis.html
引用
1阿玛托,F。,Gorvel, L., & Olive, D. (2018). Inducible Co-Stimulator (ICOS) as a potential therapeutic target for anti-cancer therapy.专家意见的治疗目标,22(4),343 - 351。
2Kumar V。,Patel, S., Tcyganov, E., & Gabrilovich, D. I. (2016). The nature of myeloid-derived suppressor cells in the tumor microenvironment.免疫学的趋势37 (3),208 - 220。
3陈,Q。,Sun, L., & Chen, Z. J. (2016). Regulation and function of the cGAS–STING pathway of cytosolic DNA sensing.自然免疫学,17(10)1142 - 1149。
4Lohard, S。,Bourgeois, N., Maillet, L., Gautier, F., Fétiveau, A., Lasla, H., ... & Barillé-Nion, S. (2020). STING-dependent paracriny shapes apoptotic priming of breast tumors in response to anti-mitotic treatment.自然通讯,11(1)论文。
5艾默里奇,J。,Mumm, J. B., Chan, I. H., LaFace, D., Truong, H., McClanahan, T., ... & Oft, M. (2012). IL-10 directly activates and expands tumor-resident CD8+ T cells without de novo infiltration from secondary lymphoid organs.癌症研究,72年(14),3570 - 3581。
6史密斯,g。,Taunton, J., & Weiss, A. (2017). IL-2Rβ abundance differentially tunes IL-2 signaling dynamics in CD4+ and CD8+ T cells.科学的信号,10(510)。
7Koenen P。,Heinzel, S., Carrington, E. M., Happo, L., Alexander, W. S., Zhang, J. G., ... & Hodgkin, P. D. (2013). Mutually exclusive regulation of T cell survival by IL-7R and antigen receptor-induced signals.自然通讯,4(1),1 - 10。
8Vilgelm a E。,& Richmond, A. (2019). Chemokines modulate immune surveillance in tumorigenesis, metastasis, and response to immunotherapy.免疫学前沿,10,333年。
9劳赫,我。,Müller, M., & Decker, T. (2013). The regulation of inflammation by interferons and their STATs.Jak-Stat,2(1)e23820。
注意:所有动物的工作是网站机构动物保健和使用委员会批准,并符合指南执行的护理和使用实验动物在一个AAALAC-accredited程序。在所有研究人道的安乐死标准预先确定的。
让我们开始对话
联系我们