日期:2021年5月
Labcorp药物开发公司临床前肿瘤学提供了新的小金博宝188网址鼠扩展CompMyeloid™面板,该面板可对已知的调节肿瘤免疫反应的髓系亚群进行深度免疫表型分析。
该小组解决了日益增长的需求,以了解免疫疗法如何调节肿瘤微环境的髓系室的促肿瘤和抗肿瘤活性。在本次技术重点报道中,我们展示了这种18色面板的力量,它提供了骨髓亚群免疫表型和功能表征的深入研究。
扩展的CompMyeloid™面板建立在我们的CompMyeloid™面板之上,它提供了调节肿瘤免疫的五种髓系亚群的一般测量。改进后的面板增加了DC1(1型)和DC2(2型)树突状细胞的描述,加上肿瘤相关巨噬细胞(TAM)、髓源性抑制细胞(MDSC)和树突状细胞亚群的功能表征的6个额外标记。表1描述了Expanded CompMyeloid™面板的组成部分,图1说明了使用小鼠Hepa 1-6肝细胞癌模型描述髓系亚群的门控策略。
表1:扩展的CompMyeloid™面板抗体及其用途描述
抗体/染料 |
描述 |
CD45 |
泛免疫细胞标记物 |
CD11b |
泛髓系标记/DC2子集标记 |
CD103 |
DC1子集标记 |
Ly-6G |
粒细胞mdsc /中性粒细胞标记物 |
Ly-6C |
Monocytic-MDSC /单核细胞标记 |
CD11c |
树突状细胞标记 |
CD24 |
树突状细胞描绘 |
F4/80 |
Pan-macrophage标记 |
MHC II类 |
M1巨噬细胞&树突状细胞标记物 |
CD206 |
M2巨噬细胞标志物 |
XCR1 |
交叉呈递/迁移树突状细胞标记物 |
CD80 |
成熟的标记 |
CD86 |
成熟的标记 |
__arg1 |
髓系功能标记 |
伊诺 |
髓系功能标记 |
PD-L1 |
T细胞抑制信号蛋白 |
CD19 |
B细胞标记 |
可行性染料 |
死细胞排除 |
扩展的CompMyeloid™面板提供7种不同髓系亚群的免疫表型分析,包括G-MDSC/中性粒细胞,M-MDSC/单核细胞亚群,M1和M2巨噬细胞,以及DC1, DC2和XCR1+树突状细胞(DC)亚群。还提供了5种骨髓功能标记来分析树突状细胞、巨噬细胞和MDSC表型。
|
|
扩展CompMyeloid™面板门控策略
与所有Labcorp药物开发临床前肿瘤免疫分型小组一致,分析从死细胞排除和随后的CD45开始金博宝188网址+免疫细胞圈定。对总CD11b进行门控+图1A显示了下游MDSC和TAM分析。图1B展示了DC分析遵循严格的门控策略,该策略首先排除了巨噬细胞、粒细胞和B细胞,从而最大限度地降低了由于不相关的和潜在的自体荧光细胞污染而影响DC测量的风险。排除门允许CD24分析(未显示),这有助于描述传统dc,通常按CD11c和MHC II类的中高表达水平分类。这些常规dc包括CD103+和CD11b+DC2子集,已被证明驱动CD8+和CD4+T细胞抗肿瘤反应1.XCR1表达已被多个小组记录为具有交叉呈现活性的dc的标记物,这是dc介导的CD8激活所需的表型+T细胞2.
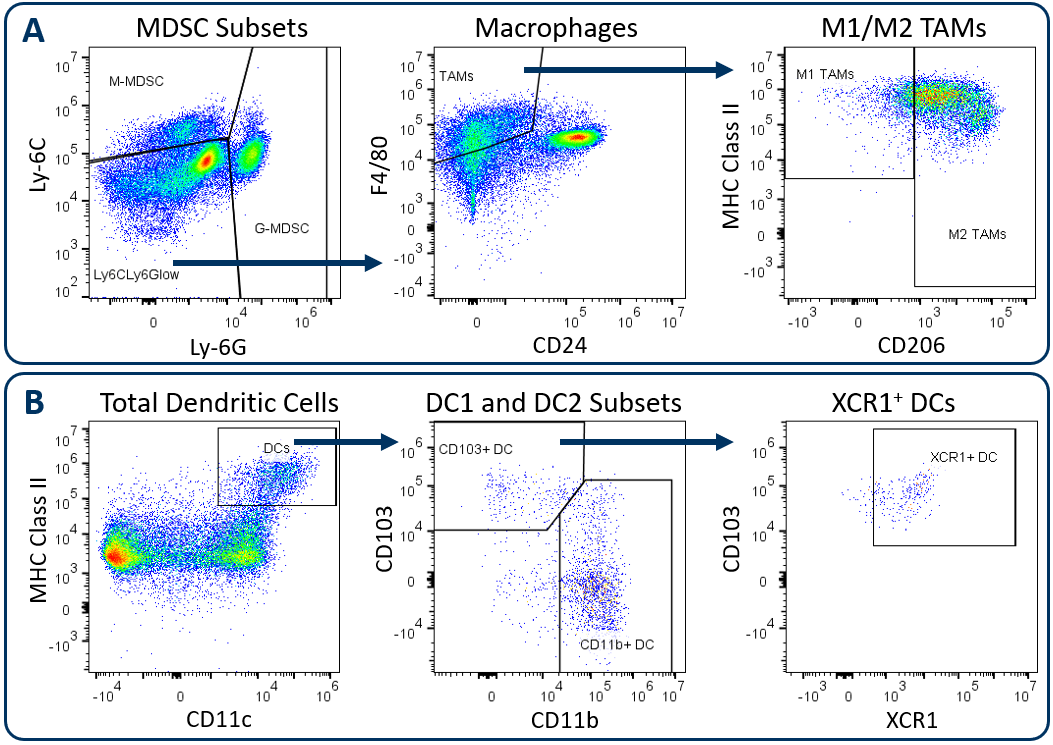
图。1。使用Expanded CompMyeloid™面板分析肿瘤浸润髓系亚群。Hepa 1-6肿瘤取自C57BL/6小鼠。(A)从CD11b开始+测量细胞门,G-MDSC和M-MDSC亚群,其余事件被划分为M1和M2 TAMs, (B)从巨噬细胞/MDSC排除门,DC1和DC2亚群和XCR1开始+测量直流分数。
所有的动物工作都由现场机构动物护理和使用委员会批准,并符合《实验动物护理和使用指南》在aaalac认证的项目内。所有的研究都预先确定了人道安乐死的标准。
MDSC和TAM亚群中iNOS和精氨酸酶1的分析
髓系亚群在肿瘤微环境中赋予活性,具有促肿瘤和抗肿瘤作用。Expanded CompMyeloid™面板提供iNOS和Arginase 1 (ARG1)的分析;生物标记是骨髓功能双重性的例子。iNOS和ARG1在肿瘤的MDSC和TAM亚群中均有表达3..在MDSCs中,iNOS和ARG1都通过竞争底物l -精氨酸来介导免疫抑制作用,从而促进T细胞增殖和抗肿瘤反应。具有高iNOS和ARG1表达的肿瘤可导致l -精氨酸缺失的环境,从而导致T细胞活化不良。因此,减少iNOS和ARG1在MDSCs中的表达的治疗有可能促进T细胞活化并改善临床结果。值得注意的是,iNOS的表达也可以以T细胞独立的方式抑制肿瘤生长,因为一氧化氮基因产物可以对肿瘤细胞产生直接的细胞毒性作用,抑制疾病进展。在不同的模型中,M1极化巨噬细胞表达的iNOS可诱导生长阻滞和凋亡细胞死亡4、5.相反,肿瘤微环境中M2极化巨噬细胞表达ARG1抑制T细胞反应的机制与MDSCs相似。
图2展示了Expanded CompMyeloid™面板如何使用皮下Hepa 1-6肝细胞癌模型检测髓系亚群中的iNOS和ARG1。我们使用这个模型是因为通过抗pd -1治疗的检查点抑制可以抑制肿瘤生长(图中未显示),因此提供了一个机会来检查检查点封锁期间骨髓间隔如何反应。与对照动物相比,抗pd -1处理增加了肿瘤浸润性粒细胞(G-)和单核细胞(M-) MDSC亚群中iNOS和ARG1的表达(图2A)。相比之下,对总TAMs的分析显示iNOS表达增加,同时ARG1表达轻微但显著降低(图2B)。值得注意的是,在iNOS阳性的TAMs中,似乎存在双相iNOS表达谱的细胞。此外,MHC II类在iNOS中的表达较高高表明抗原提呈和T细胞活化能力增强的细胞分数。由于iNOS和ARG1分别是M1和M2极化的标记物,数据表明抗pd -1治疗使TAM平衡向M1极化和抗肿瘤表型转移。这些数据也提醒我们,肿瘤免疫反应是动态的,免疫治疗可以引发多层效应,在促肿瘤和抗肿瘤活性之间推拉。
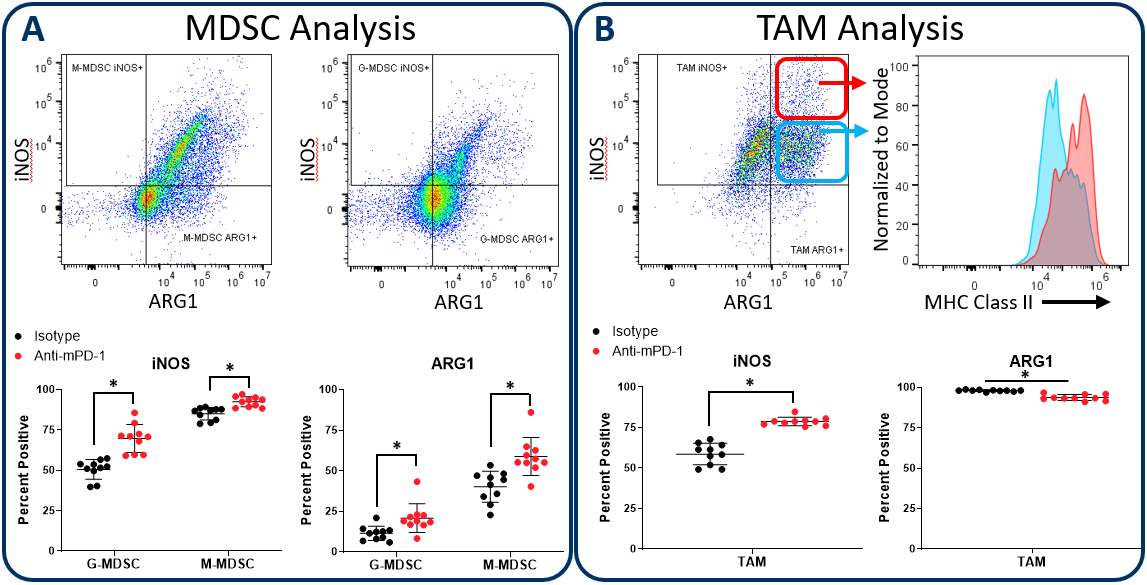
图2。MDSC和TAM亚群iNOS和精氨酸酶1分析。Expanded CompMyeloid™面板测量骨髓功能的生物标志物。在此数据中,Hepa 1-6肿瘤来自抗pd -1和同型对照抗体处理的小鼠。然后勾画MDSCs (A)和TAMs (B),并分析iNOS和ARG1的表达。TAMs差异表达相对较高(红圈包围)和较低(蓝圈包围)的iNOS表达水平,这与这些细胞片段中的MHC II类表达直接相关,这与M1极化一致(红色和绿色门是代表性的例子,在这种情况下没有用于生成如图所示的MHC II类测量)。*学生T检验(p<0.05)。
CD80和CD86成熟标记物在常规DC亚群中的表达
在肿瘤微环境中起作用的常规树突状细胞主要分为DC1和DC2两个亚群,分别通过CD103/XCR1和CD11b的表达进行鉴定。这两个子集都能激活T细胞。然而,DC1细胞已被证明有利于CD8+T细胞活化是由于引流淋巴结中肿瘤相关抗原交叉呈递的能力增强,这一过程由XCR1表达调节6.在上述Hepa 1-6研究中,使用Expanded CompMyeloid™面板测量CD80和CD86, CD80和CD86是抗原提呈细胞上表达的共刺激分子,通过细胞接触依赖机制最大限度地激活T细胞7.图3显示CD80和CD86在Hepa 1-6肿瘤来源的树突状细胞上均可检测到。此外,与同型对照组相比,抗pd -1处理增加了DC1亚群上CD86的表达水平。这些数据表明,增强的T细胞激活可能是由抗pd -1抗体处理引发的,部分原因是CD86在DC1细胞上的表达增加,以增强该亚群的共刺激活性。
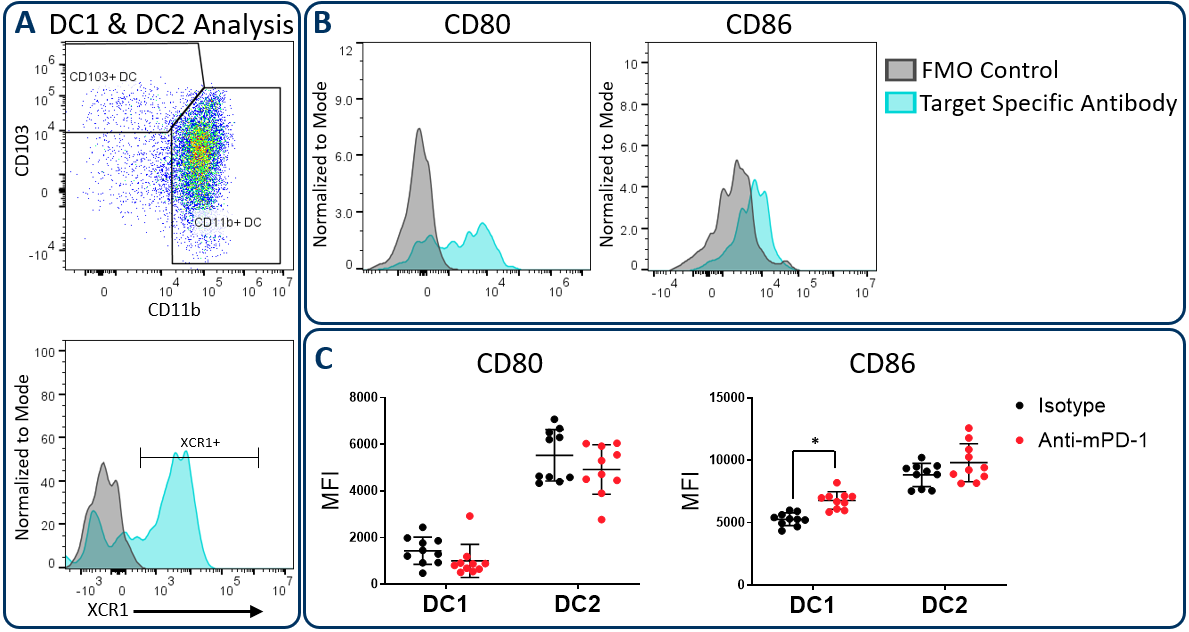
图3。CD80和CD86成熟标记物在DC亚群中的表达。使用Expanded CompMyeloid™面板测量Hepa 1-6肿瘤来源细胞中的CD80和CD86。(A)首先勾画出总的dc,然后对DC1和DC2子集进行表型分析。同时给出了用于XCR1测量的门控策略。(B)直方图显示,与DC1细胞中荧光减1 (FMO)阴性对照相比,具有代表性的CD80和CD86信号。(C)在Hepa 1-6肿瘤来源细胞的DC1和DC2亚群中测量CD80和CD86。*学生T检验(p<0.05)。
髓系亚群与肿瘤细胞的PD-L1分析
PD-1/PD-L1轴是癌症免疫治疗中最广泛的靶向通路之一。PD-L1在肿瘤细胞上的上调可能是逃避宿主保护性免疫的一种机制。此外,PD-L1在髓系细胞(包括巨噬细胞、树突状细胞和MDSCs)上的表达已被证实可进一步抑制T细胞的激活8.在某些情况下,PD-L1在这些不同的细胞类型中的表达可以具有非冗余的作用9.总之,这些观察结果强调了理解PD-L1在肿瘤髓样室中的表达如何被免疫治疗调节的重要性。图4显示了Expanded CompMyeloid™面板在TAM、DC、G-MDSC/M-MDSC子集以及CD45上测量PD-L1的能力-(非免疫)细胞,包括肿瘤细胞,也包括血管内皮细胞和其他细胞。如下图所示,PD-L1在Hepa 1-6肿瘤来源细胞的所有细胞类型中均可检测到。数据还表明,与对照动物相比,抗pd -1治疗对这些细胞中PD-L1的表达水平没有影响,这表明在该模型中PD-L1不是由检查点抑制调节的。
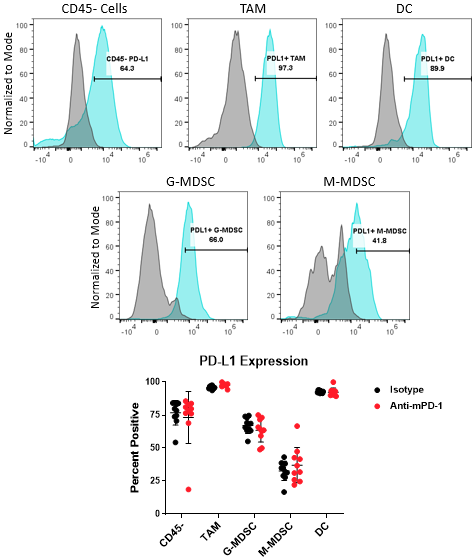
图4。骨髓亚群和肿瘤细胞的PD-L1分析。直方图显示了与CD45中荧光减1 (FMO)阴性对照相比具有代表性的PD-L1信号-来自Hepa 1-6肿瘤来源细胞的细胞和髓系亚群。所示的门用于量化在同型对照和抗pd -1抗体处理组中所含的指示亚群中PD-L1表达阳性的细胞百分比。
通过使用Expanded CompMyeloid™面板,本技术重点报道中的数据提供了证据,证明检查点抑制调节小鼠Hepa 1-6肿瘤模型中多个髓系亚群的免疫活性。此外,这些数据提供了额外的支持,即抗pd1治疗产生的影响不仅限于T细胞活性。
要了解更多关于如何将Expanded CompMyeloid™面板纳入您的临床前研究,请联系Labcorp药物开发的科学家。金博宝188网址
参考文献
1加德纳,A. &鲁菲尔,B.(2016)。树突状细胞和癌症免疫。免疫学进展,37(12),855-865。
2威利,B.,斯帕宁,E.,肖,K.,泽米克,R.,赞克,D.,普拉托,S.,……怀斯曼,J.(2015)。移行的XCR1+ CD103−和XCR1+ CD103+树突状细胞交叉呈递皮肤黑色素瘤抗原。中国肿瘤免疫学杂志,4(8),e1019198。
3.Kumar, V., Patel, S., Tcyganov, E., & Gabrilovich, D.(2016)。肿瘤微环境中骨髓源性抑制细胞的性质。免疫学进展,37(3),208-220。
4拉哈特,M. A. &海默莱因,B.(2013)。巨噬细胞与肿瘤细胞的相互作用调节一氧化氮的功能。生理学前沿,4,144。
5Vannini, F., Kashfi, K., & Nath, N.(2015)。iNOS在癌症中的双重作用。氧化还原生物学,6,334 -343。
6威利,B.,斯帕宁,E.,肖,K.,泽米克,R.,赞克,D.,普拉托,S.,……怀斯曼,J.(2015)。移行的XCR1+ CD103−和XCR1+ CD103+树突状细胞交叉呈递皮肤黑色素瘤抗原。中国肿瘤免疫学杂志,4(8),e1019198。
7斯拉维克,J. M.,和记克罗夫特,J. E.,比尔,B. E.(1999)。CD28/CTLA-4和CD80/CD86家族。免疫学研究,19(1),1-24。
8孙,C.,梅扎德拉,R.,舒马赫,T. N.(2018)。PD-L1检查点的调节和功能。免疫,48(3),434-452。
9哦,美国,吴,d . C。张,J。,纳瓦罗,A。,熊,H,不同的古巴,R。,……梅尔曼,I.(2020)。树突状细胞中PD-L1的表达是癌症中t细胞免疫的关键调节因子。自然科学进展,1(7),681-691。
连接
让我们开始对话吧
188 bet 服务中心

